
Oddělení metabolomiky Fyziologického ústavu Akademie věd České republiky (FGÚ AV ČR) poskytuje servisní měření polárních metabolitů, komplexních lipidů a sloučenin exposomu (včetně léčiv) v biologických materiálech (plazma, sérum, tkáně a buňky) metodami kapalinové chromatografie ve spojení s hmotnostní spektrometrií (LC–MS). Molekulové hmotnosti těchto látek se obvykle pohybují v rozmezí 50 až 2000 Da a jejich koncentrace se mohou pohybovat v několika řádech.
Pro analýzu hodnocených léčivých přípravků (IMP) a léčiv je laboratoř certifikována pro práci podle pravidel Správné laboratorní praxe (OECD GLP) a pravidelně monitorována národní autoritou (Státní ústav pro kontrolu léčiv).
 MetaboAtlas21
MetaboAtlas21
 GTTAtlas
GTTAtlas
LIMeX
NECÍLENÁ METABOLOMIKA, LIPIDOMIKA A EXPOSOMIKA
LC–MS postup LIMeX (LIpidy, Metabolity, a sloučeniny eXposomu) je používán pro necílenou analýzu komplexních lipidů, polárních metabolitů a sloučenin exposomu (např. léčiv).

Dvoufázová extrakční metoda s použitím methanolu, methyl terc-butyl etheru (MTBE) a vody zahrnuje dvě fáze: jednu pokrývající polární metabolity („metabolomika“) a různé sloučeniny exposomu, jako jsou léčiva („exposomika“) a druhou zahrnující komplexní lipidy („lipidomika“). Pro necílené analýzy jsou používány validované LC–MS metody.
Jelikož pouze jedna jediná LC–MS analýza nedokáže pokrýt celý metabolom/lipidom/exposom, jsou používány odlišné chromatografické metody (kapalinová chromatografie s obrácenými fázemi – RPLC a hydrofilní interakční chromatografie – HILIC) a režimy ionizace elektrosprejem pro komplexní charakterizaci daných izolovaných frakcí.
Pro pracovní postup LIMeX je používán hmotnostní spektrometr s vysokým rozlišením Thermo Q Exactive Plus ve spojení s kapalinovým chromatografem (Thermo Vanquish). Hmotnostní spektrometr sbírá pro všechny vzorky MS1 spektra a dále data-dependentní MS/MS spektra. Zatímco pro kvantifikaci se používají výšky chromatografických křivek z MS1, MS/MS spektra slouží pro anotaci sloučenin pomocí spektrálních MS/MS knihoven, nebo pro konfirmaci analytu. Získané přístrojové soubory jsou zpracovány pomocí softwaru MS-DIAL 4, včetně anotace komplexních lipidů, polárních metabolitů a dalších detekovaných sloučenin s využitím vlastních, otevřených i komerčních MS/MS spektrálních knihoven (NIST20, MassBank, MoNA).
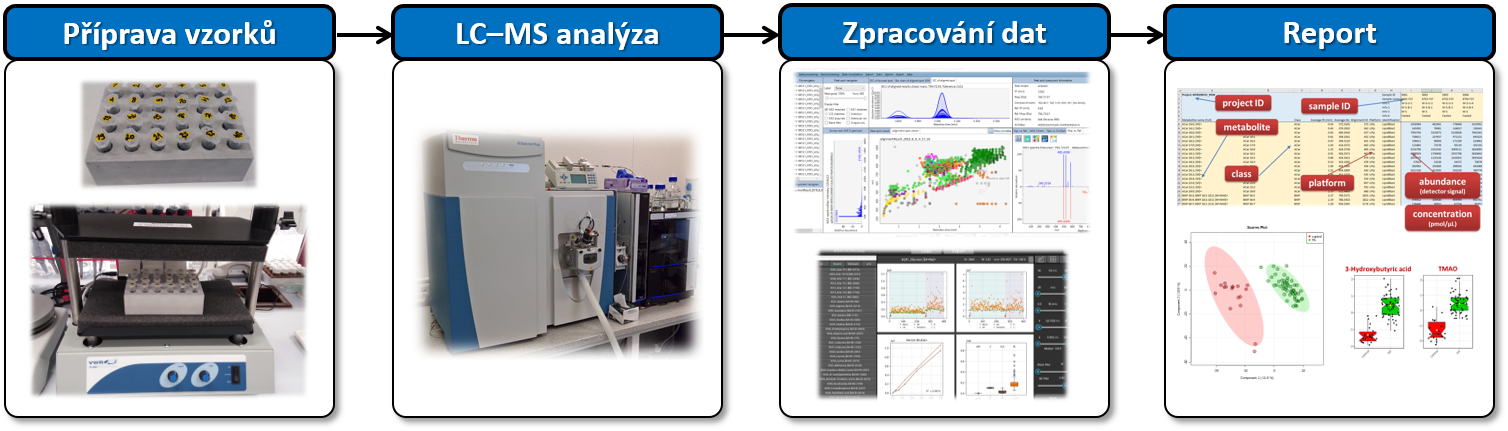
Pracovní postup LIMeX pro necílenou a cílenou analýzu komplexních lipidů, polárních metabolitů a sloučenin exposomu.
Pro humánní kohortové studie je obvykle reportováno přes 500 komplexních lipidů, 100 polárních metabolitů a desítky sloučenin exposomu (převážně složky potravin a léčiva) pomocí LIMeX-4D (tj. 4 LC–MS platformy).
Všechny sloučeniny jsou kvantifikovány jako výšky chromatografických píků a uváděny v intenzitách detektoru. Tyto hodnoty slouží jako vstup pro jednorozměrné nebo vícerozměrné statistické metody (např. t-test, míra velikosti účinku – fold change, teplotní mapy – heatmaps, analýza hlavních komponent – PCA, částečná diskriminační analýza nejmenších čtverců – PLS-DA).
Pracovní postup LIMeX používá více než 60 různých vnitřních standardů, které lze použít k odhadu absolutních koncentrací různých metabolitů detekovaných v plazmě/séru a tkáních.
Lipidové mediátory
CÍLENÁ ANALÝZA LIPIDOVÝCH MEDIÁTORŮ
Cílená kvantitativní LC–MS/MS analýza je využívána pro specifické lipidové mediátory vyskytující se ve stopových koncentracích (eikosanoidy, endokanabinoidy a estery mastných kyselin s hydroxy mastnými kyselinami (FAHFA)) a pro steroidy.
Příprava vzorků pro tyto stopové sloučeniny je náročnější a její součástí je extrakce tuhou fázi (SPE) k odstranění hojně zastoupených sloučenin (např. fosfolipidů).
Pro LC–MS analýzu se používá hmotnostní spektrometr SCIEX QTRAP 5500 provozovaný v režimu MRM ve spojený s kapalinovým chromatografem Dionex/Thermo Ultimate 3000 RSLC.
Fluxomika
CÍLENÁ FLUXOMIKA
Cílené LC–MS metody jsou používány k měření metabolitů značených stabilními izotopy pomocí 13C/2H glukózy a 2H2O. Pro extrakci vzorků se používá protokol LIMeX s následnou LC−MS analýzou, při které je hmotnostní spektrometr (Q Exactive Plus) provozován v režimu ultra vysokého rozlišení (140.000 FWHM, m/z 200).
Teoretické izotopology se počítají pro anotované metabolity v Pythonu a instrumentální soubory se zpracovávají pomocí softwaru MRMPROBS. Výšky píků jsou korigovány podle přirozené abundance prvků a izotopické čistoty traceru pomocí IsoCor softwaru.
Léčiva a léčivé látky

CÍLENÁ ANALÝZA LÉČIV A HODNOCENÝCH LÉČIV (IMP)
Cílené LC–MS metody jsou používány pro analýzu léčiv, hodnocených léčivých přípravků (IMP) a léčivých látek, včetně kandidátních léčiv ve farmakokinetických studiích a biodistribučních studiích absorpce, distribuce, metabolismu a vylučování (ADME) v režimu správné laboratorní praxe (SLP) i v režimu non-SLP.
Laboratoř je certifikována Národní autoritou (SÚKL) a má platný certifikát SLP pro chemické testy analytické chemie a klinické chemie.
U SLP studií jsou pro vývoj a validaci bioanalytických metod nezbytné následující tři kroky:

K analýze farmaceutických sloučenin se používá hmotnostní spektrometr s vysokým rozlišením Thermo Q Exactive Plus ve spojení s kapalinovým chromatografem Thermo Vanquish.
Analýza vzorků

Pro analýzu vzorků použijte prosím následující formulář. Všechny platformy mají minimální požadavek na 10 vzorků na projekt. Formulář také obsahuje informace o minimálních množstvích nebo objemech na vzorek pro každou platformu.
Formulář zašlete Dr. Tomáši Čajkovi a vzorky doručte na adresu:
- Fyziologický ústav AV ČR, v.v.i.
- Oddělení metabolomiky, místnost E-216
- Vídeňská 1083, Praha, 14220
Po obdržení vašich vzorků bude vytvořeno číslo projektu, jenž je součástí všech platforem, závěrečného reportu a slouží rovněž pro archivaci dat.
Lidé

doc. Ing. Tomáš Čajka, Ph.D. Vedoucí laboratoře
Ing. Jiří Hricko Výzkumný pracovník LC–MS, SLP Mgr. Michaela Paučová Výzkumný pracovník LC–MS, SLP Mgr. Tatyana Kobets, Ph.D. Výzkumný pracovník statistika, bioinformatika Ing. Michaela Nováková Výzkumný pracovník statistika, bioinformatika Bc. Aleksandra Shumilova Výzkumný pracovník statistika, bioinformatika Mgr. Petra Zedníková (mateřská dovolená) Výzkumný pracovník
Publikace

Oddělení metabolomiky FGÚ poskytlo data z metabolomických a lipidomických analýz pro řadu projektů po celém světě. Níže je uveden seznam článků publikovaných v recenzovaných časopisech.
- Janovska et al., Mol Metab 369 (2023) 101683 (doi: 10.1016/j.molmet.2023.101683)
- Cajka et al., Int J Mol Sci 324 (2023) 1987 (doi: 10.3390/ijms24031987)
- Castillo et al., Mol Nutr Food Res 366 (2022) 2200204 (doi: 10.1002/mnfr.202200204)
- Martínez-Ramírez et al., LWT - Food Sci Technol 3173 (2022) 114311 (doi: 10.1016/j.lwt.2022.114311)
- Paluchova et al., Free Radic Biol Med 3193 (2022) 787 (doi: 10.1016/j.freeradbiomed.2022.11.015)
- Benova et al., Mol Metab 365 (2022) 101598 (doi: 10.1016/j.molmet.2022.101598)
- Brejchova et al., Food Chem 388 (2022) 132983 (doi: 10.1016/j.foodchem.2022.132983)
- Pruchova et al., Antioxidants 11 (2022) 198 (doi: 10.3390/antiox11020198)
- Stemberkova-Hubackova et al., Clin Transl Med 12 (2022) e645 (doi: 10.1002/ctm2.645)
- Jacome-Sosa et al., Commun Biol 4 (2021) 1247 (doi: 10.1038/s42003-021-02765-z)
- Lopes et al., Cell Rep 37 (2021) 109833 (doi: 10.1016/j.celrep.2021.109833)
- Spackova et al., Cancers 13 (2021) 1709 (doi: 10.3390/cancers13071709)
- Danhelovska et al., Int J Mol Sci 22 (2021) 7270 (doi: 10.3390/ijms22147270)
- Koc et al., Sci Rep 11 (2021) 8171 (doi: 10.1038/s41598-021-87494-3)
- Sistilli et al., Nutrients 13 (2021) 437 (doi: 10.3390/nu13020437)
- Brejchova et al., Proc Natl Acad Sci USA 118 (2021) e2020999118 (doi: 10.1073/pnas.2020999118)
- Janovska et al., J Cachexia Sarcopenia Muscle 11 (2020) 1614 (doi: 10.1002/jcsm.12631)
- Bardova et al., Nutrients 12 (2020) 3737 (doi: 10.3390/nu12123737)
- Tsugawa et al., Nat Biotechnol 38 (2020) 1159–1163 (doi: 10.1038/s41587-020-0531-2)
- Smolkova et al., Sci Rep 10 (2020) 8677 (doi: 10.1038/s41598-020-65351-z)
- Paluchova et al., Mol Nutr Food Res 64 (2020) 1901238 (doi: 10.1002/mnfr.201901238)
- Benlebna et al., J Nutr Biochem 79 (2020) 108361 (doi: 10.1016/j.jnutbio.2020.108361)
- Paluchova et al., Diabetes 69 (2020) 300–312 (doi: 10.2337/db19-0494)
- Brezinova et al., Biochim Biophys Acta Mol Cell Biol Lipids 1865 (2020) 158576 (doi: 10.1016/j.bbalip.2019.158576)
- Angelisová et al., Biochim Biophys Acta Biomembr 1861 (2019) 130–141 (doi: 10.1016/j.bbamem.2018.08.006)
- Sládek et al., Biochim Biophys Acta Mol Cell Biol Lipids 1864 (2019) 158533 (doi: 10.1016/j.bbalip.2019.158533)

 ENGLISH
ENGLISH